Bentrovati, lettori, in una nuova, ed è proprio il caso di dirlo, coloratissima rubrica dedicata proprio ai pigmenti, i coloranti e tutti i segreti che la chimica nasconde riguardo i colori.
Non è facilissimo dare una definizione di colore, potremmo dire che esso è la percezione visiva di una radiazione elettromagnetica, ovvero l'interpretazione che il nostro cervello dà a una serie di impulsi elettrici provocati da un'onda elettromagnetica, cioè la luce.
Il fascio di luce che noi vediamo bianco, infatti, è in realtà composto da diverse lunghezze d'onda, ovverosia diversi colori che, uniti insieme, formano ciò che il nostro cervello percepisce come bianco.
Quando la luce colpisce un corpo, esso, a seconda della sua composizione chimica e della sua struttura, assorbirà uno o più lunghezze d'onda, riflettendo le altre che quindi arrivano al nostro occhio, mostrandoci perciò il colore complementare a quello assorbito. L'occhio umano, tuttavia, è sensibile solo a uno specchio limitato di lunghezze d'onda, quello compreso fra il rosso e il violetto, ovvero fra i 400 e i 700 nm, che viene perciò chiamato spettro della luce visibile.
Come vediamo?
Il primo organo che viene in mente quando si parla di visione è certamente l'occhio. Qui, infatti, si trovano i principali responsabili della nostra visione del colore, ovvero i recettori chiamati coni e bastoncelli, che si trovano sulla retina.
Il loro funzionamento è analogo, ma mentre i coni operano in presenza di molta luce, i bastoncelli invece ci assicurano la visione notturna, sono inoltre molto più numerosi (circa 120 milioni rispetto ai poco più di 6 milioni dei coni).
Sulla loro superficie sono presenti delle proteine fotosensibili, le opsine, che colpite dai fotoni, subiscono una trasformazione biochimica (l'isomerizzazione di un legame doppio e la dissociazione dell'11-trans-retinale dalla opsina) che invia un impulso elettrico al cervello tramite il nervo ottico.
Le proteine presenti sui recettori non sono tutte uguali, ma si differenziano in base al colore per cui dimostrano sensibilità. Abbiamo quindi, per quanto riguarda i Coni, tre tipi:
- Coni S: sensibili al blu
- Coni M: sensibili al verde
- Coni L: sensibili al rosso
Anche la distribuzione dei pigmenti sensibili a un certo colore non è uniforme: quella sensibile al rosso, ad esempio, è in numero notevolmente inferiore rispetto a quello sensibile al blu.
Questo fa sì che l'occhio umano non sia sensibile in egual misura a tutte le lunghezze d'onda, infatti la maggior sensibilità si raggiunge a 550 nm, in corrispondenza del colore giallo-verde e decade rapidamente sia verso l'ultravioletto che verso l'infrarosso.
Misurare il colore
Come facciamo, però, a dare una visione scientifica del colore? Ogni persona è diversa dall'altra e non è detto che la percezione sia uguale per tutti, senza contare le patologie come il daltonismo, che alterano gravemente la visione dei colori.
Nel 1800 è nata quindi la colorimetria, una scienza che si occupa proprio di normalizzare la misurazione del colore attraverso dei modelli.
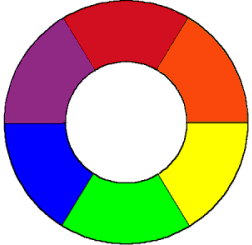 |
| Cerchio cromatico di Goethe |
Uno dei primi a occuparsi dei colori scientificamente fu Johann Wolfgang von Goethe, che fu anche il primo a formulare la teoria secondo cui non è la luce a scaturire dai colori (come aveva ipotizzato Newton) ma il contrario.
Poiché i colori derivano dalla luce, è quindi possibile ottenere, da colori detti primari, altri colori detti secondari.
A questo proposito, si possono avere due approcci: additivo, cioè la mescolanza in proporzione di rosso verde e blu per dare il bianco puro, e sottrattivo, che riguarda i pigmenti ciano giallo e magenta per dare il nero.
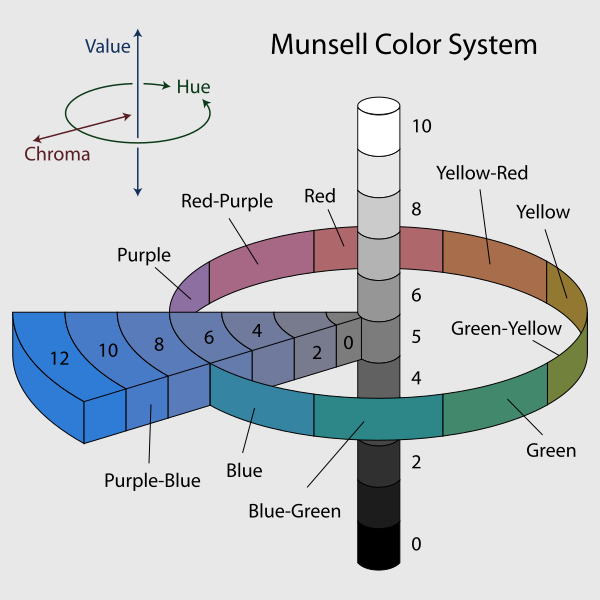
Successivamente, soprattutto a fini industriali (ma oggi è diventato importante anche per riconoscere il colore esatto di un quadro o un arazzo nella conservazione dei beni culturali), si è andato via via cercando un metodo definitivo di classificazione dei colori secondo le tre principali caratteristiche cromatiche:
- tinta, che caratterizza il colore come appartenente alla famiglia dei blu, dei rossi, dei verdi, ecc.;
- luminosità, cioè la sua posizione tra il bianco (chiarezza massima) e il nero (chiarezza minima);
- saturazione, che definisce la purezza di un colore, cioè la sua distanza dal colore grigio di uguale chiarezza
Questo tipo di classificazione venne introdotta all'inizio del 1900 da a Albert Henry Munsell, un pittore americano.
Nonostante abbia molti pregi, questo sistema non permette la mescolanza dei colori, in quanto i complementari non sono in posizione opposta.
Vengono oggi utilizzati anche sistemi più complessi, che sfruttano le formule matematiche per dare una classificazione quanto più completa possibile dei colori.
Un esempio importante è quello sviluppato dalla CIE (Commissione Internazionale dell'Illuminazione) nel 1931.
Considerando la lunghezza d'onda dominante di ogni colore e la sua saturazione, ottenevano un grafico a campana
Questo grafico però non teneva conto della componente psicologica della percezione cromatica umana, perciò nel 1976 svilupparono un altro sistema di classificazione detto L*a*b.
In questo sistema ogni colore è individuato da tre valori:
- L, cioè la luminanza, espressa in percentuale dove 0 è il bianco e 100 il nero
- a, la gamma di colori che va dal verde al rosso
- b, la gamma di colori che va dal blu al giallo
Questo sistema si basa sulla teoria dello psicologo Ewald Hering secondo cui la visione del colore, nel nostro cervello, è codificata come la risultante di tre processi che si oppongono: bianco/nero, rosso/verde, giallo/blu. Il primo spiega il fatto che i colori possono essere chiari o scuri, mentre il mescolamento delle quattro tinte "uniche" produce tutte le tinte percepite.
Su questo sistema si sono quindi basati tutti i successivi metodi di identificazione di colori specifici, come la stampa in quadricromia o il pantone.
Perché una sostanza è colorata?
La risposta a questa domanda, a questo punto, non dovrebbe più essere un mistero: una sostanza chimica, un oggetto se vogliamo essere più generali,è colorato perché quando viene colpito dalla luce assorbe determinate lunghezze d'onda (porzioni di luce) e ne riflette altre.
A livello atomico, questo vuol dire che gli elettroni, che se ne stanno tranquilli a una certa energia che è propria di ogni elettrone di ogni atomo e di ogni molecola, quando sono colpiti dai fotoni della luce, si agitano, o come diciamo noi chimici, si eccitano, saltando a un livello di energia superiore. A seconda delle caratteristiche di ogni molecola, il quantitativo di energia assorbito dalla luce è diverso, quindi le lunghezze d'onda assorbite sono diverse.
Dopo qualche tempo (ricordiamo comunque che sono tempi incredibilmente piccoli) l'elettrone eccitato dall'incontro con i fotoni, perde quell'energia e ritorna al suo stato precedente, rilasciando quell'energia sotto forma di luce emessa, quella stessa luce che poi arriva ai nostri oggi e ci permette di vedere i colori.
Per approfondire:
- La teoria dei colori di Johann Wolfgang Goethe, John Murray Editore
- https://munsell.com/






Nessun commento:
Posta un commento